美國FDA於8月4日公告2021年醫療器材各項申請費用,依據醫療器材使用者費用(Medical Device User Fees),新的費用生效日期從2020.10.01到2021.09.30。
本次各項申請案的使用者費用平均增加7%,而年度註冊費則是增加了5%,依FDA宣稱,使用者費用有助於幫助FDA提高監管過程的效率,並縮短將安全有效的醫療器材上市時間。
M.D. 發表在 痞客邦 留言(8) 人氣(1,666)
原先ISO 14971在2007年版本對於執行風險管理的人員能力有簡單的說明及要求,到了2019年版本時,更強調執行風險管理人員的教育、訓練、技能、經驗;適當時,這些人員應該具備特殊醫療器材或相似醫療器材的知識和經驗和它的使用、涉及的技術或所採用的風險管理技術。
ISO/TR 24971在2020年版本中更進一步提供了擔任風險管理人員範例,人員或功能及其相關知識和經驗列舉如下但不限於:
M.D. 發表在 痞客邦 留言(0) 人氣(1,174)
ISO/TR 24971:2020 醫療器材 - ISO 14971應用指南已於2020.6正式公告,本文件提供指引幫助廠商開發、實施和維護醫療器材的風險管理流程,達到ISO 14971:2019醫療器材風險管理的應用要求。
廠商依ISO 14971:2019執行風險管理流程時,可一併參照ISO/TR 24971:2020,可以讓醫療器材風險管理系統更加完善。
M.D. 發表在 痞客邦 留言(0) 人氣(2,585)
因【醫療器材管理法】第十五條第規定「醫療器材製造業者及從事輸入或維修之販賣業者,應視醫療器材類別,聘僱技術人員。前項醫療器材類別、技術人員資格及比例、教育訓練之課程時數及其他相關事項之辦法,由中央主管機關定之」,故TFDA擬定【醫療器材技術人員管理辦法】草案,全文共十四條,訂定要點如下:
M.D. 發表在 痞客邦 留言(0) 人氣(973)
歐盟MDR Annex I General Safety and Performance Requirements (GSPR)是任何醫療器材投放到歐盟市場必須符合基本要求之一,這些要求是針對產品特性來決定是否滿足,因此廠商必須列出每一項GSPR,提出如何滿足要求的簡短摘要或解釋為什麼要求不適用的原因並列出可參考的書面證據。在大多情況之下,滿足這些要求的最接直方法是確定器材符合適用的歐盟調合標準(Harmonised Standard)等。
M.D. 發表在 痞客邦 留言(0) 人氣(3,318)
TFDA原定現行QSD歐盟技術合作方案簡化模式TCP II於MDR於今年(2020年)5月25日結束,轉由臺歐TCP III接續運行,但因COVID-19疫情,歐盟執委會已決定延後MDR正式施行日期到2021年5月26日,所以TFDA同步調整臺歐TCP II的終止日期到2021年5月25日,之後會執行臺歐TCP III。
M.D. 發表在 痞客邦 留言(0) 人氣(630)
因【醫療器材管理法】第三十七條第三項規定由中央主管機關訂定醫療器材臨床試驗之管理範圍、作業規範、申請程序、審查基準、利益迴避、資訊揭露、監督管理、查核、受試者同意書等事項遵行辦法,故TFDA擬定【醫療器材優良臨床試驗管理辦法】草案共八章,總計七十二條,其八章訂定要點如下:
M.D. 發表在 痞客邦 留言(0) 人氣(191)
因應醫療器材管理法於109年1月15日制定公布,而管理法要求的醫療器材製造業者建立醫療器材品質管理系統,因此TFDA由原來的藥物優良製造準則第三編醫療器材優良製造規範擬改為醫療器材品質管理系統準則,英文名稱則由原GMP改為Quality Management System, QMS(為國際上一般認可的說法)。
本草案全文共79條其訂定要點如下:
M.D. 發表在 痞客邦 留言(1) 人氣(3,821)
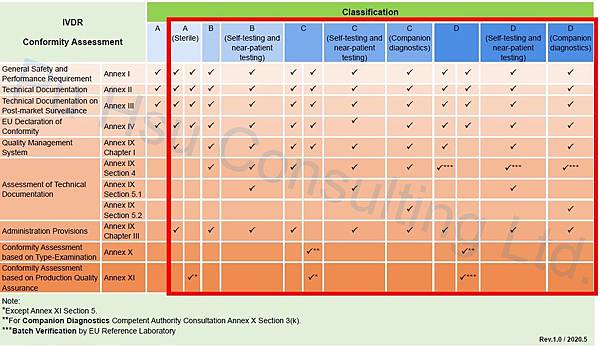 歐盟IVDR醫療器材認證流程(即符合性評鑑程序),以不同等級(Class A, B, C, D)會有不同的規範,若為Class A IVD產品,廠商只需符合IVDR要求並擬定自我宣告(Declaration of Conformity),產品就可在歐盟市場販售;而Class A(Sterile), B, C, D IVD產品可選擇符合性評鑑程序向Notified Body提出申請,取得CE認證後產品才能上市。
歐盟IVDR醫療器材認證流程(即符合性評鑑程序),以不同等級(Class A, B, C, D)會有不同的規範,若為Class A IVD產品,廠商只需符合IVDR要求並擬定自我宣告(Declaration of Conformity),產品就可在歐盟市場販售;而Class A(Sterile), B, C, D IVD產品可選擇符合性評鑑程序向Notified Body提出申請,取得CE認證後產品才能上市。 M.D. 發表在 痞客邦 留言(0) 人氣(975)
歐盟IVDR(Regulation (EU) 2017/746 In Vitro Diagnostic Medical Device Regulation)於2017年5月25日公告後,IVDR對於產品的分類規則將原先在IVDD裡的分類由List A, List B, Others變成Class A, Class B, Class C, Class D,其風險等級及管控力道是由ClassA到D逐步加強,Class A可由廠商符合IVDR相關要求並擬定自我宣告後產品即可上市,而Class B, Class C, Class D則須向公告機構(Notified Body)提出符合性評鑑程序,確認其產品符合IVDR要求後才能上市。
由於原先IVDD只管控了約10-20%IVD產品,其餘IVD產品的廠商可自我宣告後產品即可上市,但IVDR一旦執行,情況將翻轉,80-90%IVD廠商必須提出IVDR符合性評鑑程序,因此這項改變對於廠商而言是一大挑戰,IVDR將於2022年5月開始執行,廠商可重新評估並確認自家IVD產品的等級(表一)後即可開始規劃如何符合IVDR的要求。
M.D. 發表在 痞客邦 留言(1) 人氣(1,881)

